Akkumulatoren - wiederaufladbare Speicher für elektrische Energie Teil 1/3
Aus ELVjournal
03/2008
0 Kommentare
Geschichtlicher Rückblick
Der
österreichische Archäologe Wilhelm König machte im Jahr 1936 etwa 30 km
südöstlich von Bagdad Ausgrabungsfunde, von denen er annahm, es handle
sich um eine frühe Form der Trockenbatterie. Die Fundstücke, ca. 15 cm
hohe tönerne Krüge, enthielten – durch einen Bitumenpfropfen im Hals
voneinander isoliert – eine an der Unterseite geschlossene Hülse aus
Kupferblech und darin einen Eisenstab. 1938 beschrieb König seinen Fund
in einem Fachartikel „Ein galvanisches Element aus der Partherzeit?“
(Forschungen und Fortschritte 14 [1938]; 8–9), worin er als Anwendung
das Galvanisieren von Kunst- und Kultobjekten mit hauchdünnen
Goldschichten für möglich hielt. Auch über medizinische Anwendungen wie
eine Art Entkeimung des Wassers spekulierte er. Über das Für und Wider
solcher Deutungen wird seitdem heftig gestritten. Auch wenn viele Fragen
offen bleiben, ist es doch eine faszinierende Vorstellung, dass die
Menschheit vielleicht schon vor mehr als 2000 Jahren über elektrische
Spannungsquellen verfügen konnte.
|
| Bild 2: Luigi Galvanis Froschschenkel-Experimente regten Volta zur Erforschung des Phänomens der Kontaktelektrizität an. |

|
| Bild 1: Alessandro Volta legte die Grundlagen der modernen Elektrochemie. |
|
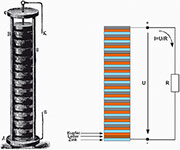
| Bild
3: Die Volta’sche Säule war das erste Primärelement, dessen Spannung
sich durch die Höhe des Elementarzellenstapels in weiten Grenzen
einstellen ließ. Damit war der Weg zur systematischen Erforschung
elektrochemischer und -physikalischer Phänomene frei. |
Die
Spannung einer Volta-Zelle mit Zinkplättchen (elektrochemisches
Standardpotential -0,76 V) und Kupfer (elektrochemisches
Standardpotential 0,34 V) beträgt ca. 1,1 V. In der dargestellten
Volta’schen Säule mit 14 gestapelten Elementen wird entsprechend eine
Spannung von ca. 15,4 V erzeugt. Der elektrochemische Mechanismus: Die
Zinkatome geben zwei Elektronen ab und gehen als Zinkionen in Lösung.
Die dabei freigesetzten Elektronen erzeugen in der Zinkelektrode einen
Elektronenüberschuss, der sich über einen Verbraucher als
Elektronenfluss zur Kupferelektrode (entgegengesetzt zur technischen
Stromrichtung!) abbaut. An den Kupferplättchen wird Wasserstoff
freigesetzt. Weil die elektrochemischen Vorgänge in der Volta’schen
Säule nicht umkehrbar sind, lässt sie sich nicht wieder aufladen.
Deshalb zählt man sie zur Klasse der Primärelemente. Das
Verdienst, die Urform des Akkumulators – also einen Stromspeicher –
erfunden zu haben, gebührt dem deutschen Apotheker Johann Wilhelm Ritter
(1776–1810). Er deutete die dabei ablaufenden chemischen Vorgänge als
Erster richtig. Die von ihm 1803 vorgestellte Ritter‘sche Ladungssäule
bestand ähnlich wie Voltas Anordnung aus abwechselnd geschichteten
Metallscheiben mit porösen Zwischenlagen zur Aufnahme einer
elektrolytischen Flüssigkeit („kochsalznasse Pappplatten“). Ritter
verwendete jedoch einheitlich Kupferplättchen. So konnte natürlich
zunächst keine Spannung entstehen. Als Ritter jedoch seine Anordnung
eine Zeit lang mit einer Volta’schen Säule verband und dann wieder
trennte, war an ihren Klemmen eine belastbare Spannung festzustellen.
Der Grund liegt in der Veränderung der chemischen Beschaffenheit der
Oberflächen der Kupferscheiben durch den Ladestrom. Während der
Stromabgabe bilden sich die Veränderungen zurück. Solange dieser Vorgang
nicht abgeschlossen ist, gibt die Ritter’sche Säule Strom ab. Es
dauerte gut 50 weitere Jahre, bis 1854 der deutsche Arzt und Physiker
Wilhelm Josef Sinsteden (1803–1891) zeigte, dass zwei Bleiplatten in
verdünnter Schwefelsäure besonders gute Stromspeichereigenschaften
aufwiesen. Sinsteden kann somit als Vater des Blei-Akkumulators
angesehen werden, obwohl er seine Erfindung nicht wirtschaftlich
verwertete. Der französische Physiker Gaston Planté (1834–1889) brachte
den Blei-Akkumulator 1859 zur technischen Reife. Von den vielen
Erfindern, welche die Leistungsfähigkeit und Zuverlässigkeit des
Blei-Akkumulators stetig verbesserten, hat 1886 der luxemburgische
Ingenieur Henri Tudor (1859– 1928) gerippte Bleiplatten mit vergrößerter
Oberfläche eingesetzt. Die großtechnische Herstellung des Tudor-Akkus
nahm 1887 der IndustrielIe Adolph Müller in der von ihm gegründeten
Aktiengesellschaft für Akkumulatorenherstellung (AFA) auf. Die AFA rief
1904 ihre Tochtergesellschaft VARTA (Vertrieb, Aufladung, Reparatur
Transportabler Akkumulatoren) für die Fertigung kleiner und
transportabler Akkumulatoren ins Leben. Seitdem wird der Blei-Akku in
der heute noch üblichen Kastenform vorwiegend zum Starten von
Kraftfahrzeugen eingesetzt. Akkumulatoren
hatten bis zur Entwicklung der dynamoelektrischen Maschine 1866 durch
Werner von Siemens (1816– 1892) noch keine praktische Bedeutung, denn zu
ihrer Ladung war immer erst eine Primärbatterie nach Art einer
Volta’schen Säule erforderlich. Daher rührt auch die Bezeichnung
Sekundärbatterie. Mit dem Dynamogenerator stand nun ein leistungsfähiger
Stromerzeuger zur Verfügung, der einen Akkumulator einfach und
preiswert laden konnte. So spielte der Blei-Akku in den Anfängen der
Automobiltechnik zur Speicherung der Antriebsenergie in elektromotorisch
angetriebenen Fahrzeugen eine bedeutende Rolle. Akkumulatoren - Idealvorstellung und Realität
Die
wünschenswerten und die chemisch-physikalisch reali sierbaren
Eigenschaften eines Akkumulators werden trotz aller Forschungen nicht
zur Deckung zu bringen sein. So steht zum Beispiel die Forderung nach
einem großen Speicher volumen im Gegensatz zur möglichst kompakten Größe
eines Akkus. Aber lassen wir unserer Fantasie einmal freien Lauf. Der
„ideale“ Akkumulator soll die folgenden Attribute vereinen:
- geringes Volumen und Gewicht
- hohe Speicherdichte
- weiter Arbeitstemperaturbereich
- minimale Selbstentladung für lange Lagerzeit
- Hochstromfestigkeit
- kurze Ladezeiten
- hoher Wirkungsgrad
- freie Formgebung
- in Herstellung und Betrieb und Entsorgung keine giftigen Stoffe benötigend bzw. absondernd
- lange Lebensdauer
- Sicherheit in allen Betriebszuständen
- recycelbar
- billig in der Herstellung ...
Dieser
Wünschekanon hört sich nach der „eierlegenden Wollmilchsau“ oder der
„Quadratur des Kreises“ an. In der Realität sind die Vielzahl der
Akkumulatorentypen daher auf die bestmögliche Erfüllung eines bestimmten
Aufgabenkreises optimiert, sei es in Spielzeug, Leuchten, mobiler
Unterhaltungselektronik, Laptops, Uhren, Funktechnik, Alarmtechnik,
Notstromversorgungen, Solarstromversorgungen, Kraftfahrzeugen,
Elektrowerkzeugen oder in elektronischer Kleidung (i-wear, smart
clothes). Der Blei-Akkumulator
Im
Blei-Akkumulator finden wir alle Elemente wieder, die jeder Akkumulator
in unterschiedlicher Ausgestaltung aufweist: positive Elektrode,
Elektrolyt und negative Elektrode. Deshalb beschreiben wir sein
Wirkungsprinzip etwas eingehender. Die (vereinfachten) chemischen
Vorgänge an den Elektrodenplatten sind noch relativ einfach
nachzuvollziehen (etwas Restwissen aus dem Chemieunterricht braucht’s
aber schon!). Die in den Reaktionsgleichungen verwendeten Größen sind O
(Oxygen = Sauerstoff), H (Hydrogen = Wasserstoff), S (Sulfide =
Schwefel) und Pb (Plumbum = Blei). Der Buchstabe e steht für ein
Elektron und die hochgestellten Plus- und Minuszeichen (+, -) deuten auf
einen Mangel (+) oder einen Überschuss (-) an Elektronen hin. Wir haben
es dann mit positiv oder negativ geladenen Ionen zu tun. Der
Akkumulator wird meist ohne Elektrolytfüllung ausgeliefert. Dann besteht
die positive Elektrode aus PbO2 (Bleidioxid) und die negative Elektrode
aus porösem Blei (Pb, Bleischwamm). Nach dem Einfüllen der mit Wasser
(H2O) verdünnten Schwefelsäure (H2SO4) sind die Voraussetzungen für eine
erste Entladung gegeben. Man bezeichnet den unbefüllten Akku deshalb
auch als „trocken vorgeladen“.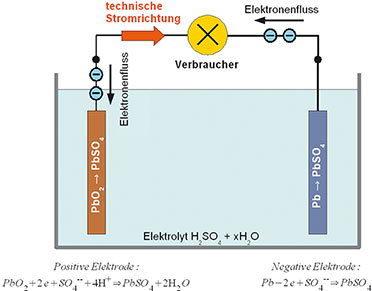
|
| Bild
4: Dieses Bild fasst die elektrochemischen Vorgänge bei der Entladung
eines Blei-Akkumulators zusammen. Mit fortschreitender Entladung sinkt
die Dichte des Schwefelsäureelektrolyten. |
|
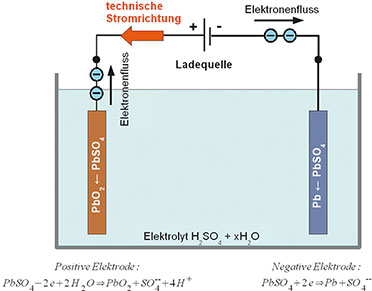
| Bild 5: Bei der Ladung des Blei-Akkumulators steigt die Dichte des Schwefelsäureelektrolyten so lange an, bis er „gast“. |
Ladung:
Beim entladenen Blei-Akku bestehen beide Platten aus Bleisulfat (PbSO4)
(Abbildung 5). Im Zuge des Ladens gibt die positive Platte Sulfationen
(SO4 --) an den Elektrolyten ab und verbindet sich mit dem Sauerstoff
des Elektrolytwassers unter Freisetzung von Wasserstoffionen zu
Bleidioxid. Dabei werden zwei Elektronen zur Stromleitung frei. Im
Verlauf der Ladung steigt die Säurekonzentration wieder an. Die Vorgänge
an den Platten bei Entladung bzw. Ladung sind in den Gleichungen in
Abbildung 4 bzw. Abbildung 5 dargestellt.
Der
Blei-Akkumulator mit flüssigem Elektrolyten hat heute in der
Unterhaltungselektronik keine Bedeutung als mobile Energiequelle. Für
einen lageunabhängigen Betrieb ist der Ersatz des flüssigen Elektrolyten
„wässrige Schwefelsäure“ (H2SO4) durch ein Gelsubstitut (durch Zugabe
von Kieselsäure erstarrte Schwefelsäure) und der gasungsfreie
geschlossene Betrieb Voraussetzung. Der Blei-Gel-Akku erfüllt beide
Anforderungen. Er wurde früher in portablen Tonbandgeräten eingesetzt,
heute noch in unterbrechungsfreien Stromversorgungen (USV) für den PC,
in leistungsstarken Handscheinwerfern und Campingleuchten. Mit der
zunehmenden Miniaturisierung der Elektronik konnte der Blei-Akku nicht
mithalten und spielt heute in portablen Geräten keine Rolle mehr. Trotz
seiner geringen Energiedichte von ca. 30 Wh/kg kann der Blei-Akkumulator
wegen seines geringen Innenwiderstandes kurzzeitig hohe Ströme liefern.
Er wird deshalb bis heute als Starterbatterie für Verbrennungsmotoren
verwendet. Der elektrische Anlassermotor zieht für wenige Sekunden
Ströme von 100 bis 1000 A, ohne dass dabei die Spannung zu tief abfallen
darf. Der Blei-Akku kann dies in einem weiten Temperaturbereich zu
günstigen Kosten leisten. Der Nickel-Cadmium-Akkumulator
Der
Nickel-Cadmium-Akkumulator (NiCd) kann auf eine über 100-jährige
Geschichte zurückblicken. Etwa ab 1890 beschäftigten sich der
amerikanische Erfinder Thomas Alva Edison (1847–1931) und der
schwedische Physiker Waldemar Jungner (1869–1924) mit Akkumulatoren,
deren Elektrolyt alkalisch ist und somit nicht an der Elektrodenreaktion
teilnimmt, sondern nur die Aufgabe eines flüssigen Ionenleiters mit
gleich bleibender Konzentration erfüllt. Als negative Elektrode setzte
Edison Eisen, Jungner dagegen Cadmium ein, als positive Elektrode
wählten beide Nickel. 1899 ließ sich Jungner auf seinen
Nickel-Cadmium-Akkumulator ein Patent erteilen, 1901 wurde Edisons
Urheberschaft am Cadmium-Eisen-Akkumulator geschützt. 1947 machte ein
Verfahren von Georg Neumann (1898–1976) die Herstellung des gasdicht
verschlossenen NiCd-Akkus möglich.Wegen
seiner Robustheit und im Vergleich zum Blei-Akku hohen Energiedichte
dominierte das Nickel-Cadmium-System den Markt der Klein-Akkumulatoren
nahezu vollständig. Die großen Stückzahlen im Umlauf und ein nicht
vollständig geschlossener Recyclingkreislauf stellen heute wegen des
giftigen Schwermetallbestandteils Cadmium aber ein Umweltproblem dar.
Deshalb wird seit dem 26.9.2006 gemäß EU-Batterie-Richtlinie 2006/66/EG
das „In-Verkehr-bringen“ von „Gerätebatterien und -akkumulatoren, die
mehr als 0,002 Gewichtsprozent Cadmium enthalten, einschließlich
solcher, die in Geräte eingebaut sind“ untersagt. Die Umsetzung dieser
Richtlinie in die nationale Gesetzgebung muss bis zum 26. September 2008
erfolgen. In zylindrischer Form enthält der NiCd-Akku einen Wickel aus
gestapelten Schichten, bestehend aus der Minuselektrode (geladen:
Cadmium Cd, entladen: Cadmiumhydroxid Cd[OH2]), einer mit wässriger
Kalilauge (KOH + Wasser) getränkten Separatorfolie und der Pluselektrode
(geladen: Nickeloxidhydrat NiO[OH], entladen: 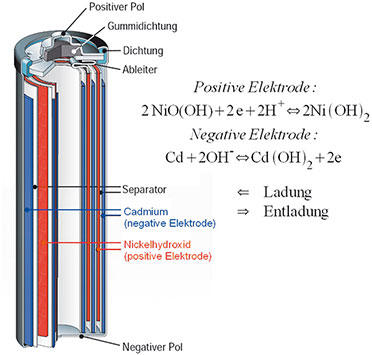
|
| Bild 6: Schichtenaufbau eines NiCd-Akku-Wickels |
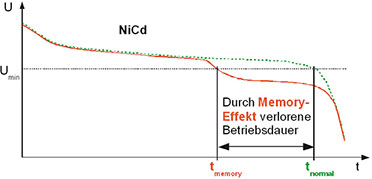
|
| Bild 7: Wird der Entladezyklus eines NiCd-Akkus nicht vollständig durchlaufen, verliert er an Kapazität (Memory-Effekt). |
Der Nickel-Metallhydrid-Akkumulator
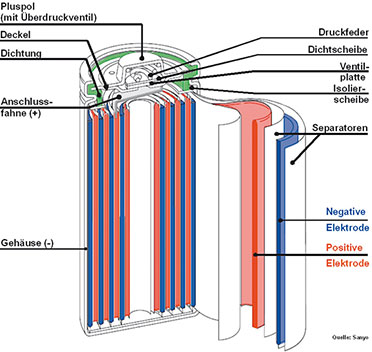
|
| Bild 8: Schnittbild eines NiMH-Akkus |
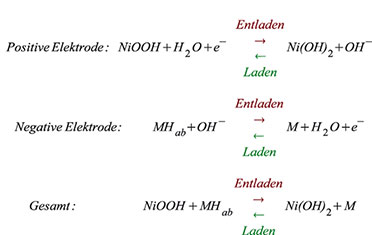
Die
Reaktionen an den Elektroden und in Gesamtheit gibt Gleichung 1 wieder.
In Gleichung 1 ist M die Wasserstoff speichernde Metallverbindung und
Hab der absorbierte Wasserstoff. MHab ist also nicht als chemische
Formel zu verstehen, sondern als Anschrieb für ein Mischmetall M mit
absorbiertem Wasserstoff Hab. An der Gesamtreaktion ist das
Wirkungsprinzip des NiMHAkkus zu erkennen: Der Wasserstoff bewegt sich
beim Laden von der positiven zur negativen Elektrode und umgekehrt beim
Entladen, ohne dass der Elektrolyt (verdünnte Kalilauge KOH) einen
Anteil an der Reaktion hätte. Er wird weder in seiner Konzentration noch
in der Zusammensetzung verändert, sondern dient ausschließlich als
Transportmedium für die negativen Hydroxid-Ionen (OH-). Das erleichtert
die Herstellung gasdichter Zellen. Im unbelasteten Zustand stellt sich
zwischen den Elektroden eine Leerlaufspannung von ca. 1,3 V ein. Den
Vorstellungen vom Ideal kommen der Eneloop-Akku (Hersteller Sanyo) und
Folgeprodukte anderer Hersteller ein gutes Stück näher. Sie weisen eine
stark verringerte Selbstentladung (Low Self Discharge: LSD-NiMH) von
typ. 10 % im Jahr auf. Deshalb werden sie vorgeladen ausgeliefert und
können meist sofort eingesetzt werden. Möglich wurde dies durch eine
Superkristall-Legierung (Superlattice Alloy) als Material für die
negative Elektrode und eine modifizierte positive Elektrode. Den
Nachteil einer etwas geringeren Kapazität gleicht die flachere
Entladekurve aus. Für Foto- und Filmkameras, die ja stets einsatzbereit
sein sollen, sind LSD-NiMH-Akkus deshalb eine gute Wahl. Im zweiten Teil
dieses Artikels werden weitere Speicher für elektrische Energie wie
Li-Ionen-, Li-(Ionen-)Polymer- und RAM-Akkus, Super-Caps,
Brennstoffzellen usw. beleuchtet, die Systeme aus der Sicht der
Anwendungen genauer unter die Lupe genommen und die Besonderheiten der
Ladeverfahren beschrieben. Fachbeitrag online und als PDF-Download herunterladen
Inhalt
Sie erhalten den Artikel in 2 Versionen:
 als Online-Version
als Online-Version
 als PDF (5 Seiten)
als PDF (5 Seiten)
Sie erhalten folgende Artikel:
- Akkumulatoren - wiederaufladbare Speicher für elektrische Energie Teil 1/3
| weitere Fachbeiträge | Foren | |
Hinterlassen Sie einen Kommentar:
 Videos
Videos
 Foren
Foren
 Technik-News
Technik-News
 Wissen
Wissen
 Fachbeiträge
Fachbeiträge
 Fachmagazin & Abo
Fachmagazin & Abo









 als Online-Version
als Online-Version als PDF (5 Seiten)
als PDF (5 Seiten)