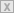Akkumulatoren - wiederaufladbare Speicher für elektrische Energie Teil 2/3
Aus ELVjournal
04/2008
0 Kommentare
Der Li-Ionen-Akkumulator
Einen
weiteren Sprung in Bezug auf die Energiedichte (Energieinhalt pro
Raumeinheit: volumetrische Energiedichte, Energieinhalt pro
Masseneinheit: gravimetrische Volumendichte) ermöglicht die Technologie
von Akkumulatoren auf der Grundlage von Lithium-Elektroden. Dem stehen
aber auch eine Reihe von Nachteilen gegenüber, insbesondere die
Empfindlichkeit gegen ungeeignete Lade- und Entladevorgänge und ein
starker Leistungsrückgang bei niedrigen Temperaturen. Lithium ist das
leichteste alkalische Metall mit einer Dichte von 0,53 g/cm³ und in
reiner Form äußerst reaktionsfreudig. Zugleich hat es das größte
Standardpotential (-3,05 V) unter den Metallen auf der elektrochemischen
Spannungsreihe, was bei den heute gebräuchlichen Bauformen und
Elektrodenmaterialpaarungen zu einer typischen Zellenspannung von 3,2 V
führt. Wegen des geringen Gewichts und der hohen Energiedichte von über
100 Wh/kg wird dieser Akku-Typ zunehmend bei mobilen Anwendungen
eingesetzt.Der
grundsätzliche Aufbau eines Li-Ionen-Akkus gleicht dem des NiCd- und
NiMH-Akkus. Ein Schichtenstapel aus durch Separatorfolien getrennten
Dünnschichtelektroden wird zu einem Zylinder aufgerollt. Die Elektroden
bestehen aus Verbundmaterialien. Für die negative Elektrode sind dies
Graphitverbindungen (enthalten Kohlenstoff, C), für die positive
Lithiumverbindungen (enthalten Lithium, Li, z. B. LiMO2). Das
Wirkungsprinzip beruht auf der reversiblen Einlagerung von positiven
Lithiumionen (Li+) in die Elektroden (Insertionselektroden,
Intercalationselektroden), die ihre Gitterstruktur als Wirt zur
Verfügung stellen (Wirtsgitter). 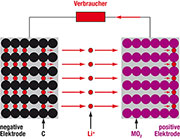
|
| Bild 10: Beim Entladen „schwingen“ die Ionen zur positiven Elektrode zurück (Swing-Akku). |
|
| Bild 9: Beim Laden eines Li-Ionen-Akkus werden positive Lithiumionen im Wirtsgitter der negativen Elektrode eingelagert. |
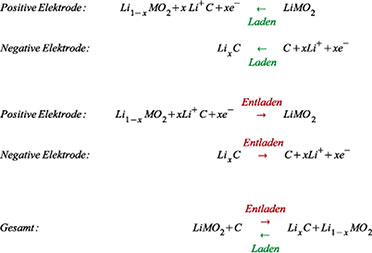
Die
Reaktionen an den Elektroden und in Gesamtheit bei Ladung und Entladung
zeigt Gleichung (2). Bei allen Reaktionen gemäß Gleichung (2) tritt
Lithium nur in Verbindungen auf und niemals metallisch rein (atomar).
Das muss auch unbedingt vermieden werden, weil sonst durch Gasbildung im
Elektrolyten und Überhitzung Explosionen und Brände auftreten können.
Bei leistungsstarken Akkumulatoren wird deshalb jede einzelne Zelle
gegen Überspannung und -temperatur gesichert. Dass dies selbst
renommierten Herstellern nicht immer vollständig gelingt, beweisen die
vielen Rückrufaktionen bei Handy-, Laptop- und Kamera-Lithium-
Ionen-Akkus im Lauf der letzten Jahre. Ganz
aktuelle Entwicklungen an der amerikanischen Stanford- Universität
stellen eine Verzehnfachung der Kapazität von Lithium-
Ionen-Akkumulatoren in Aussicht. Weil die Menge an Lithium, die im
Kohlenstoff-Wirtsgitter eingelagert werden kann, die Kapazität des Akkus
begrenzt, hat man nach Stoffen gesucht, die ein höheres
Absorptionsvermögen aufweisen. Dies leistet z. B. Silizium, aber mit dem
Nachteil einer größeren Volumenänderung, die zu Brüchen und damit zur
Degradation und letztlich Zerstörung der negativen Elektrode führt. Das
Team um Prof. Yi Cui hat nun Nanodrähte aus Silizium eingesetzt, die bei
der Aufnahme von Lithium nicht brechen. In einem Mitte Dezember 2007
online publizierten Aufsatz in „Nature Nanotechnology“ mit dem Titel
„High-performance lithium battery anodes using silicon nanowires“ sehen
die Forscher große Anwendungsfelder im Bereich elektrisch angetriebener
Fahrzeuge, mobiler Geräte wie Laptops und Unterhaltungselektronik sowie
autarken Solarstromsystemen. Wegen der ausgereiften Technik, die hinter
der Herstellung von Silizium-Nanodrähten steht, sind die Entwickler
optimistisch, dass die Technologie bald in ein Vermarktungsstadium
eintreten wird. Der Lithium-(ionen-)Polymer-Akkumulator
Im
Gegensatz zu Lithium-Ionen-Akkus ist der Elektrolyt eines
Lithium-(Ionen-)Polymer-Akkus (LiPo) nicht flüssig, sondern als Folie
oder Gel ausgebildet. Seine Energiedichten liegen über denen von
Lithium-Ionen-Akkus. 200 Wh/kg sind heute erreichbar. Leider ist die
Ionendurchlässigkeit trockener Folien- Elektrolyten erst über 60 °C
akzeptabel, mit Gelelektrolyten schon bei Raumtemperatur (20 °C). In
Bezug auf Spitzenströme sowohl bei Entladung als auch Ladung hinkt
dieser Akku-Typ seinen Wettbewerbern (noch) etwas hinterher. Meistens
sind Ströme in der Größenordnung von 1C (Zahlenwert der mAh-Kapazität x
mA, ein 1800-mAh- Akku darf also mit höchstens 1800 mA ge- bzw. entladen
werden) die zulässige Obergrenze.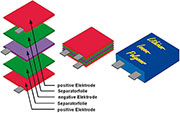
|
| Bild 11: Typischer planarer Schichtenaufbau eines LiPo-Akkus |
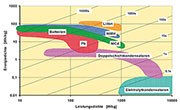
Energiedichten im Vergleich
Der
ideale Akkumulator soll möglichst viel Energie pro Volumeneinheit
speichern und dabei möglichst leicht sein. Mit anderen Worten: In einem
Diagramm, welches in der Senkrechten die volumetrische Energiedichte in
Wattstunden/ Liter (Wh/l) und in der Waagrechten die gravimetrische
Energiedichte in Wattstunden/Kilogramm (Wh/kg) darstellt, sind
Akkumulatorensysteme, die einen möglichst großen Abstand zu beiden
Achsen haben, wünschenswert.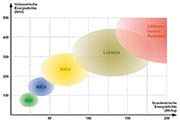
|
| Bild
12: Für die Akkus der Zukunft wird man das Diagramm nach rechts oben
erweitern müssen, denn dort sind die Technologien angesiedelt, die
kleine, leichte und energiereiche Akkus ermöglichen. |
Exotischer Zwitter: RAM-Akku
Wiederaufladbare
Alkali-Mangan-Zellen weisen Eigenschaften von Primärzellen (Batterie)
und Sekundärzellen (Akkumulator) auf. Sie sind unter der Bezeichnung
RAM-Akkus (Rechargeable Alkaline Manganese) im Handel und können als
Alternative zu Primärbatterien eingesetzt werden. In ihren Eigenschaften
unterscheidet sich die RAM-Zelle von einem herkömmlichen Akku, z. B.
einem Nickel-Metall- Hyd rid-Akku. Vorteilhaft ist die Klemmenspannung
von 1,5 V anstelle von typ. 1,2 V bei NiMH-Akkus und die geringe
Selbstentladungsrate von weniger als 0,5 %/Monat. Negativ zu werten ist
die relativ geringe Anzahl von Ladezyklen (typ. 25, max. 100) und eine
mit jedem Ladezyklus abnehmende Kapazität. Die Zellspannung sollte nicht
unter 1,2 V abfallen, weil sich sonst die Lebensdauer verkürzt.Für
hohe Lastströme ist der RAM-Akku nicht geeignet. Versucht man, ihm
diese abzufordern, kann er dabei Schaden nehmen. Mit herkömmlichen
Ladegeräten können RAM-Zellen nicht geladen werden (der „Lade“-Vorgang
müsste eigentlich „Regeneration“ heißen). Zum Laden einer RAMZelle mit
Konstantstrom muss dieser regelmäßig unterbrochen werden, um die
Zellenspannung im Leerlauf zu messen. Übersteigt das Messergebnis 1,73
V, wird mit der Ladung so lange ausgesetzt, bis die Zellenspannung
wieder auf 1,69 V abgefallen ist. Übrigens kann man alle
Alkali-Batterien mehrmals (je nach Anwendung 3- bis 10-mal)
regenerieren. Auch mit einem geeigneten „Ladegerät“ nimmt dabei aber die
Gefahr des Undichtwerdens oder Auslaufens zu, ein Explodieren ist nicht
möglich. Im einfachsten Fall kann ein NiCD-NiMH-Langsamlader (>14 h)
verwendet und die Regeneration nach 6 bis 12 Stunden abgebrochen werden
(http://www2.ife.ee.ethz.
ch/~zinniker/batak/alkali_regenerieren/index.html). Doppelschicht-Kondensatoren (DLC)
Schon
seit dem Physikunterricht wissen wir, dass in einem Kondensator
elektrische Energie gespeichert werden kann. Für das elektrostatische
Speichervolumen spielt die Kapazität des Kondensators und damit die
Fläche A der leitfähigen Kondensatorflächen, ihr Abstand d und die
relative Dielektrizitätskonstante εr des isolierenden Materials zwischen
den Kondensatorflächen eine Rolle.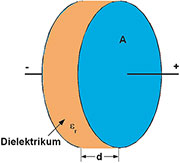
|
| Bild 13: Prinzipdarstellung eines Kondensators |
In
Gleichung (3) und Abbildung 13 werden die Zusammenhänge verdeutlicht.
Es ist also ganz offensichtlich, wo man ansetzen muss, um Kondensatoren
mit großer Kapazität (Superkondensatoren) herzustellen – an der Fläche
(möglichst groß) und am Abstand (möglichst klein). Bei den sogenannten
Doppelschicht- Kondensatoren (auch DLC: Double Layer Capacitor, Super-
Cap, GoldCap … genannt) schafft die Elektrochemie an der Grenzfläche
zwischen flüssigem Elektrolyten und festen metallischen Elektroden
beides. Ein isolierendes Dielektrikum ist also nicht erforderlich. 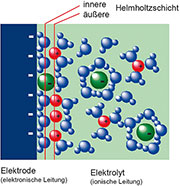
|
| Bild
14: An der Grenzfl äche zwischen Elektrolyt und Elektrode bildet sich
eine Helmholtz’sche Doppelschicht als äußerst dünnes Dieelektrikum. |
|
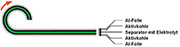
| Bild 15: Der Schichtenstapel eines DLC wird aufgewickelt. |
Damit
ergibt sich ein möglicher Energieinhalt gemäß Gleichung (4). Ein
konstanter Strom I kann dem DLC während einer Zeit t gemäß Gleichung (5)
entnommen werden. Moderne Entwicklungen zeigen, dass durch den Einsatz
von Kohlenstoff-Nanoröhrchen (CNT: Carbon Nanotube) die Energiedichte
von DLCs auf 100 Wh/kg gesteigert werden kann und damit bereits an die
von Li-Ionen-Zellen mit typ. 120 Wh/kg heranreichen würde
(http://lees-web.mit.edu/ lees/ultracapacitors.htm). Vorteile des DLC
Der
DLC hat einige herausragende Vorteile gegenüber herkömmlichen Primär-
und Sekundärzellen. Wegen des kleinen Innenwiderstandes kann er sehr
schnell (<1 Sek.) mit hohen Strömen ge- und entladen werden und das
bei einer enorm hohen Zyklenanzahl (bis zu einer Million Zyklen!). Die
daraus resultierende hohe Leistungsdichte eröffnet viele Anwendungen mit
hohem Marktpotential.
|
| Bild 16: Diverse Bauformen von Super-Kondensatoren (Quelle: Maxwell) |
|
| Bild
17: Klar erkennbar ist der Vorteil des DLCs gegenüber Primär- und
Sekundärelementen in Bezug auf die Leistungsdichte und damit das
Hochstromverhalten. |
Fachbeitrag online und als PDF-Download herunterladen
Inhalt
Sie erhalten den Artikel in 2 Versionen:
 als Online-Version
als Online-Version
 als PDF (4 Seiten)
als PDF (4 Seiten)
Sie erhalten folgende Artikel:
- Akkumulatoren - wiederaufladbare Speicher für elektrische Energie Teil 2/3
| weitere Fachbeiträge | Foren | |
Hinterlassen Sie einen Kommentar:














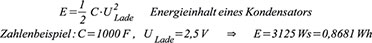
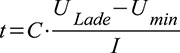


 als Online-Version
als Online-Version als PDF (4 Seiten)
als PDF (4 Seiten)