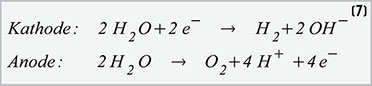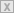Akkumulatoren - wiederaufladbare Speicher für elektrische Energie Teil 3/3
Aus ELVjournal
05/2008
0 Kommentare
Der Silber-Zink-Akku
Der
Silber-Zink-Akku sollte eigentlich in dieser Artikelserie nicht näher
beschrieben werden, da er nur wenige Lade- und Entladezyklen erlaubte
und zu Auskristallisierungen auf der Zink-Elektrode (Dendritenbildung)
und dadurch hervorgerufenen inneren Kurzschlüssen neigte. Nach neuesten
Forschungen sind diese Probleme nun aber weitgehend ausgeräumt und der
Silber-Zink-Akku muss als ernst zu nehmende Konkurrenz zum
Lithium-Ionen-Akku betrachtet werden. In seiner klassischen Grundform
besteht der Silber-Zink-Akku aus einer positiven Elektrode (entladen:
Silber Ag; geladen: Silberoxid AgO) und einer negativen Elektrode
(entladen: Zinkhydroxid Zn(OH)2; geladen: Zink Zn) in Kalilauge (KOH,
typ. Dichte 1,4 g/cm3). Die Klemmenspannung einer geladenen Zelle liegt
bei 1,5 bis 1,6 V. Die elektrochemischen Reaktionen zeigt Gleichung (6).
|
| Bild 18: Der Schichtenaufbau einer Silber-Zink-Zelle |
Dabei
fällt an der Gesamtreaktion auf, dass beim Laden Wasser (H2O) entsteht,
wodurch der Elektrolyt an Dichte (Konzentration) verliert. Hier ist
(umgekehrt wie beim Bleiakkumulator) ein verdünnter Elektrolyt das
Kennzeichen einer geladenen Zelle. Die kalifornische Zpower Inc. (bis
Mitte 2008 Zinc Matrix Power) beschreibt auf ihrer Homepage den Aufbau
ihrer Silber- Zink-Zellen wie folgt (Abbildung 18):
A:
Die
negative Elektrode (Zink-Anode) ist ein Polymer-Zink- Verbundmaterial,
welches formstabil ist und ein Dendritenwachstum hemmt. Das wirkt der
Bildung innerer Kurzschlüsse entgegen.
B:
Der Separator ist
ein Folienschichtenstapel mit mehreren Aufgaben. Zum einen hindert er
Dendriten am Durchtritt zur negativen Elektrode und vermeidet dadurch
die gefürchteten inneren Kurzschlüsse. Zum anderen erlaubt er die freie
Ionenbewegung von der Katode zur Anode und schützt die Silber- Katode
vor einer Degeneration.
C:
Die positive Elektrode
(Silber-Katode) besteht aus mit Nano partikeln beschichtetem Silber, was
die Leitfähigkeit steigert und somit den Innenwiderstand herabsetzt.

|
| Bild 19: Labormuster eines Silber-Zink-Akkus |
Die Brennstoffzelle
Der
Begriff Brennstoffzelle ist die im Sprachgebrauch übliche Kurzform für
die Wasserstoff-Sauerstoff-Brennstoffzelle. Die Brennstoffzelle wandelt
chemische in elektrische Energie um und zählt deshalb zu den
galvanischen Elementen. Allerdings hat sie die chemische Energie nicht
gespeichert, sondern erhält sie in Form von Brennstoffen zugeführt, die
sie über eine „kalte Verbrennung“ direkt in elektrische Energie
umwandelt.Geschichtliches

|
| Bild 20: 1838 wies Christian Friedrich Schönbein das Grundprinzip der Brennstoffzelle nach. |

|
| Bild 21: William Robert Grove baute die erste gebrauchstüchtige Wasserstoffzelle. |
|
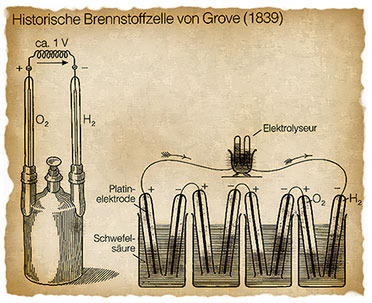
| Bild
22: Das Grove’sche Element und die Reihenschaltung von elementaren
Wasserstoffzellen zum Betrieb eines Elektrolyseurs (Quelle RWE). |
|
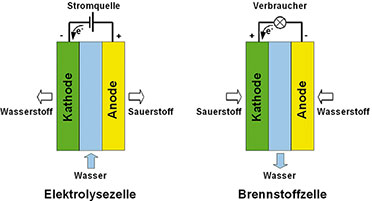
| Bild 23: In einer Brennstoffzelle laufen die umgekehrten Vorgänge wie in einer Elektrolysezelle ab. |
Die
Vorgänge in der Brennstoffzelle sind etwas komplexer (Gleichung 8).
Zunächst wird an der Katode Sauerstoff reduziert, d. h., er wird durch
Elektronenaufnahme in Sauerstoffionen gewandelt. An der Anode gibt der
Wasserstoff Elektronen ab (Oxidation), die über den Verbraucher zur
Katode fließen und dabei elektrische Arbeit verrichten. Die positiv
geladenen Sauerstoffprotonen verbinden sich mit den Wasserstoffionen zu
Wasser. Von außen betrachtet haben sich Wasserstoff und Sauerstoff unter
Freisetzung von Elektronen zu Wasser vereinigt. Dabei wird theoretisch
genau die Energie frei, die zur elektrolytischen Zerlegung von Wasser in
seine Bestandteile notwendig ist. Der herkömmliche Weg zur
Stromgewinnung hätte über die Verbrennung von Wasserstoff in einer
Verbrennungsmaschine (Energiewandlung: thermisch → mechanisch) und durch
diese zum Antrieb eines Generators (Energiewandlung: mechanisch →
elektrisch) geführt. Diese zwei mit Verlusten, Geräuschen und Verschleiß
verbundenen Zwischenstufen spart man sich bei der „kalten Verbrennung“
in der Brennstoffzelle. Bauformen von Brennstoffzellen
AFC
Der
älteste praktisch eingesetzte Brennstoffzellentyp ist die alkalische
Brennstoffzelle (AFC: Alkaline Fuel Cell). Sie entspricht Groves’
Konstruktion, hat aber einen alkalischen Elektrolyten, meist wässrige
Kalilauge KOH. Bei einer Arbeitstemperatur um 80 °C verarbeitet sie
hochreinen Wasserstoff und Sauerstoff. Sie ist sehr empfindlich gegen
Kohlendioxid CO2, welches den Elektrolyten und die Katalysatorelektroden
zerstört. Deshalb ist der Betrieb mit Luftsauerstoff nicht möglich,
wodurch dieser Brennstoffzellentyp im Alltag keine große Bedeutung
erlangt hat. In der Weltraumfahrt und in Unterseebooten, wo die teuren
Anforderungen an die Reinheit des Sauerstoffs keine ausschlaggebende
Rolle spielen, kommt die AFC wegen ihres hohen Wirkungsgrades (ca. 63 %)
und der erzielbaren elektrischen Leistungen (bis 100 kW) dagegen oft
zum Einsatz.PEMFC
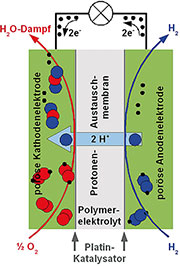
|
| Bild 24: Das Brennstoffzellenprinzip: Wasserstoff und Sauerstoff verbinden sich zu Wasser. Dabei werden Elektronen freigesetzt. |

|
| Bild 25: Brennstoffzellen werden zu einem Stapel (Stack) angeordnet, um höhere Ausgangsspannungen zu erzielen. |

|
| Bild 26: BZ-Stack der BASF |
Weitere Brennstoffzellentypen
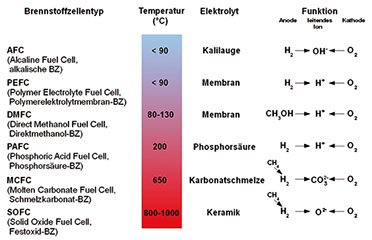
|
| Bild 27: Brennstoffzellentypen und ihre wichtigsten Parameter |
Warum Brennstoffzellen?
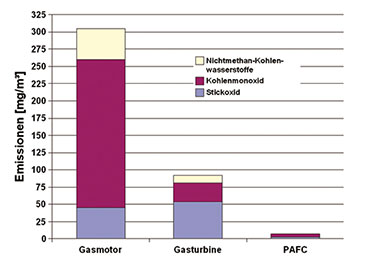
|
| Bild 28: Die geringen Schadstoffemissionen einer Phosphorsäure-BZ im Vergleich zu Gasmotor und -turbine |
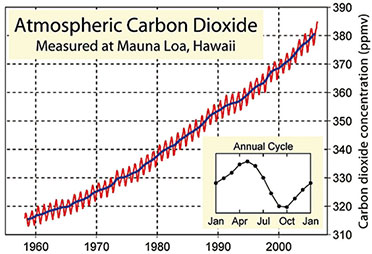
|
| Bild
29: Die Keeling-Kurve: In 50 Jahren ist die
Kohlenstoffdioxidkonzentration in der Erdatmosphäre um fast ein Viertel
angestiegen. |

|
| Bild
30: In luftdicht abgeschlossenen Gefäßen produzieren Mikroalgen unter
Schwefelmangel Wasserstoff (Quelle: Ruhr-Universität Bochum). |
Fachbeitrag online und als PDF-Download herunterladen
Inhalt
Sie erhalten den Artikel in 2 Versionen:
 als Online-Version
als Online-Version
 als PDF (5 Seiten)
als PDF (5 Seiten)
Sie erhalten folgende Artikel:
- Akkumulatoren - wiederaufladbare Speicher für elektrische Energie Teil 3/3
| weitere Fachbeiträge | Foren | |
Hinterlassen Sie einen Kommentar:
 Videos
Videos
 Foren
Foren
 Technik-News
Technik-News
 Wissen
Wissen
 Fachbeiträge
Fachbeiträge
 Fachmagazin & Abo
Fachmagazin & Abo













 als Online-Version
als Online-Version als PDF (5 Seiten)
als PDF (5 Seiten)